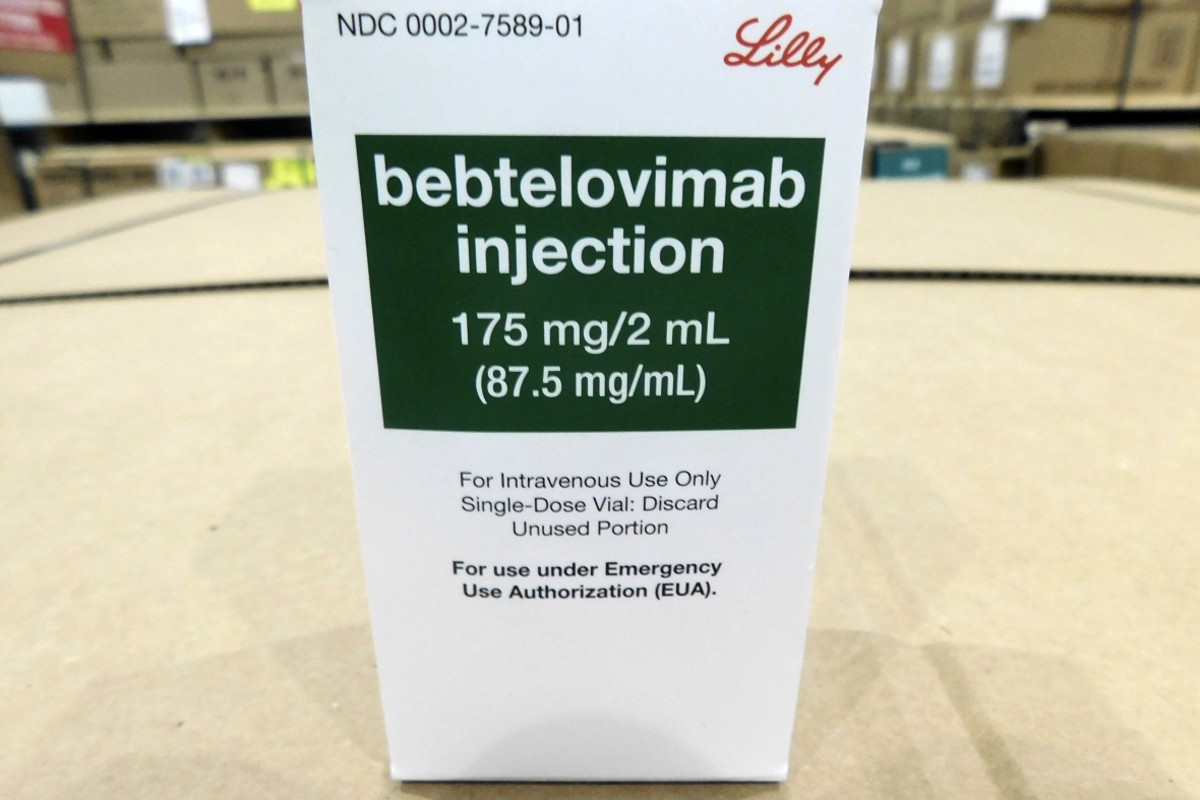
La Food and Drug Administration statunitense ha dato il via libera a un nuovo anticorpo monoclonale contro il Covid-19, attivo contro la variante Omicron. L’agenzia Usa ha rilasciato un’autorizzazione all’uso di emergenza per il farmaco di Eli Lilly, il cui utilizzo è indicato per le persone con Covid da lieve a moderato, adulti e pazienti pediatrici di età pari o superiore a 12 anni (e peso di almeno 40 kg) con un test positivo e ad alto rischio di progressione verso forme gravi, ricovero o morte, pazienti per i quali le opzioni terapeutiche alternative approvate o autorizzate non sono accessibili o clinicamente appropriate.
Il farmaco, chiamato Bebtelovimab, non è invece autorizzato per i pazienti ricoverati in ospedale per Covid o che necessitano di ossigenoterapia. Il trattamento infatti non è stato studiato nei pazienti col virus che sono già ospedalizzati. “Gli anticorpi monoclonali, come il bebtelovimab, possono essere associati a esiti clinici peggiori quando somministrati a persone ricoverate per Covid che richiedono ossigeno ad alto flusso o ventilazione meccanica”, si legge nella nota della Fda.
“L’azione di oggi rende disponibile un altro anticorpo monoclonale che mostra attività contro Omicron, in un momento in cui stiamo cercando di aumentare ulteriormente l’offerta”, ha affermato Patrizia Cavazzoni, direttore del Center for Drug Evaluation and Research della Fda. “Questa autorizzazione è un passo importante per soddisfare la necessità di più strumenti per curare i pazienti mentre continuano ad emergere nuove varianti del virus”.
Anche perché Omicron aveva ridotto sensibilmente il numero di monoclonali utilizzabili. La Fda spiega che sta monitorando attentamente le varianti virali circolanti e la loro sensibilità ai monoclonali autorizzati. “Test di laboratorio – spiega l’agenzia – hanno mostrato che bebtelovimab mantiene l’attività sia contro la variante Omicron che contro la sottovariante Omicron 2.
Argomenti: covid-19